|
Q1: 如何评判样本能否做代谢组或蛋白组(比如-80℃保存了两年、或者用麻醉剂进行处理)?
A: 针对这种情况要咨询公司销售,评估样本的可检测性。一般情况下,样本-80℃保存半年对蛋白、代谢检测影响不大,可正常使用。如果保存时间更久,可与销售咨询,进行预实验,通过预实验的检测结果判断样本情况。
如果使用麻醉剂等试剂对样本进行预处理,对物质检测结果一定会有影响的。
Q2: 蛋白、代谢检测可否分批送样?
A: 不建议分批送样,因为仪器稳定性、实验操作人员不同、质谱仪保养清洁等原因会导致不同批次检测结果出现明显的批次效应,且批次效应很难消除,有时批次间的差异会大于样本间的差异。如果真的由于试验需要时间梯度或者样本自身原因,建议先取样,用液氮猝灭后至于-80℃保存,等到所有样本收集完再统一检测。
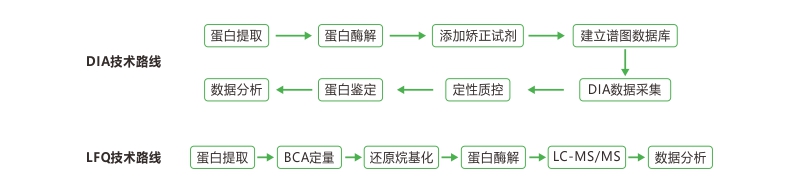
Q3: 如何选择蛋白质组检测方法?
A: 如果研究常规蛋白质组,在样本数少于32个时,建议使用TMT,大于32个时可使用DIA或者direct DIA。DIA和direct DIA的区分主要在于,direct DIA不需要建库,可直接使用DIA结果进行定性定量,整个项目周短,成本低。
Q4: DIA技术优势这么明显,现在很受欢迎,那蛋白质检测是不是只用DIA就可以?
A: 并不是,研究人员需要根据研究目的选择更合适的技术。
如,做常规蛋白质组实验,样本数是16个,我们更建议大家使用TMT。
原因有:1)定量结果更多。对于常规动植物组织,TMT可通过大量的分级(fractionation),提升定量蛋白的数量,而DIA不做分级,定量的结果要低于TMT;
2)无法发挥DIA稳定性。TMTpro可对16个样本同时标记,混合上机检测,没有平行性的问题。而DIA则是16个样本单独上机检测,DIA的稳定性没有发挥空间。
3)性价比不高。 DIA的实验流程比较复杂,需先建一个图谱library。在样本数量少的情况下,先花机时完成libirary构建,再花机时进行样本的DIA检测。反而不如一次性做TMT来得经济、快捷。
如果是样本数较多(大于32个)或者检测血液样本时可优先选择DIA。
|